فصل2:
انواع پیوند ها
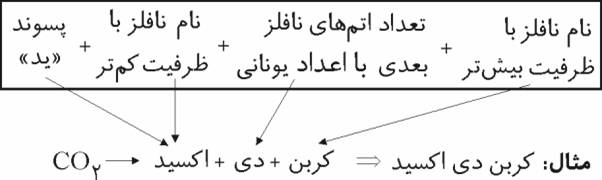
تعریف پیوند شیمیایی به ارتباط الکترونی اتم ها یا مولکول ها با یکدیگر گفته می شود از فرمول شیمیایی هر ماده دو مطلب را می تون فهمید:1-نوع عناصر سازنده ی آن ماده2-تعداد هر نوع از اتم های آن
مثال:
|
فرمول شیمیایی |
نماد |
|
Naاتم سدیم |
Na |
|
O2 |
O |
|
Mg |
Mg |
|
P4 |
P |
|
S8 |
S |
|
H2O |
O&H |
|
NaCl |
Cl&Na |
|
CH4 |
4H&C |
ظرفیت ها
|
ظرفیت |
گروه |
|
یک |
گروه یک |
|
دو |
گروه دو |
|
سه |
گروه سه |
|
چهار |
گروه چهار |
|
سه |
گروه پنج |
|
دو |
گروه شش |
|
یک |
گروه هفت |
|
صفر |
گروه هشت |
برای نوشتن فرمول شیمیایی نا فلزات معمولا یک عدد دو در پایین جلوی نماد شیمیایی می نویسیم مانند:O2وN2وH2
فرمول شیمیایی نافلزات مانند نمادشان نوشته می شود یعنی بدون عدد نوشته می شود در ترکیب فلزات با نافلزات اول در سمت چپ نماد فلز نوشته می شود سپس در سمت راست آن نماد نافلز.

تعریف پیوند کوالانسی:پیوندی است بین دو اتم نافلز که در ان هر اتم الکترونی را بهئ اشتراک دیگری می گذارد.
تعریف ترکیب مولکولی:به هر ماده ای پیوند کوالانسی داشته باشد گفته می شود.

مثال:
ترکیب مولکولی:1-عنصر: مولکول هیدروژن=اتم هیدروژن+اتم هیدروژن
2- ماده مرکب
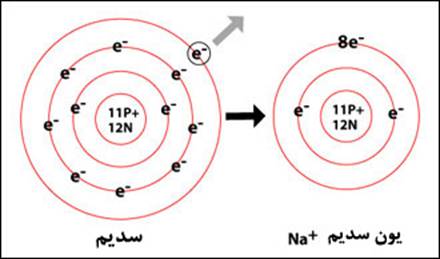
تعریف یون:به اتم بار دار یون می گویند
راه های تولید یون:1-اگر اتمی الکترون از دست بدهد یون مثبت تولید می کند
یون مثبت تولید می کند
2-اگر اتمی الکترون بگیرد  یون منفی تولید می کند
یون منفی تولید می کند
 نکته ها
نکته ها
1-فلزات مایل به از دست دادن الکترون اند  پس یون مثبت تولید می کنند
پس یون مثبت تولید می کنند
2-نافلزات مایل به گرفتن الکترون هستند  پس یون منفی تولید می کنند به جز هیدروژن(+H)هلیم(2+He)
پس یون منفی تولید می کنند به جز هیدروژن(+H)هلیم(2+He)
تعریف پیوند یونی:پیوندی است بین یک اتم فلز و یک اتم نافلز که در آن اتم فلز یک الکترون به اتم نافلز می دهد پس دو یون مثبت و منفی تشکیل می شود.
به یون منفی آنیون می گویند و به یون مثبت کاتیون.
تعریف ترکیب یونی:هر ماده ای که پیوند یونی داشته باشد یک ترکیب یونی است.

ویژگی ترکیبات یونی:اگر ترکیبات یونی بتوانند در آب حل شوند آب را رسانای برق می کنند.
آب خالص رسانای برق نیست - گچ و آهک در آب حل نمی شوند.
الکترولیت:به مایعی که بتواند برق را از خود عبور دهد الکترولیت می گویند
الکترولیز:به عمل تجزیه ی مواد مرکب به وسیله ی برق را الکترولیز می گویند
مثل:1-یونیزه کردن
2H2O 2H2&O2
2H2&O2
2-جدا سازی قطبها
قطبهای منفی:2H+2e H2
H2
قطبهای مثبت:2O- O2&2e
O2&2e
3-حاصل بدست آمده:
2H2O  2H2&O2
2H2&O2
بهتر است توجه داشته باشیم که به قطب الکترود هم می گویند.
اسید و باز
اسید:به هر ماده ی ترش مزه ای که در آب یون Hمثبت تولید کند گفته می شود.
اسید های معروف عبارتند از:1-اسید کلرید ریک دارای PH=3
2-اسید سولفوریک دارای PH=1/5
3-اسید نینتریک دارای PH=0-1
راه های شناسایی اسید:1-با محلول لیتموس(تورنسل):اسید ها آن را قرمز می کنند.
2-کاغذ PHزرد:اسید ها این کاغذ را قرمز می کنند.
3-با محلول برموتیمول بلو:اسید ها این محلول آبی را زرد می کنند.
4- واکنش اسید و فلز:اسید + فلز گاز هیدروژن و نمک
گاز هیدروژن و نمک
5-واکنش اسید و آهک:اسید +آهک دی اکسید کربن +آب +نمک
دی اکسید کربن +آب +نمک
6-واکنش اسید و باز:باز +اسید آب +نمک
آب +نمک
 نکته
نکته
عامل اسیدی H است،یعنی ابتدای فرمول شیمیایی هر اسیدی H به کار رفته است.
به جزH2oوH2o2.
باز(قلیا):به هر ماده ی تلخ مزه ای که در آب یون -OHتولید کند باز می گویند.
قوی ترین باز ها عبارتند از:1-سود سوز آور:NaoHهیدروکسید سدیم
2-پتاس:KoHهیدروکسید پتاسیم
3-قلیاب:(آب آهک)(Ca(oHهیدروکسید کلسیم
راه های شناسایی باز:1-با محلول لیتموس:باز ها این محلول را به رنگ آبی در می آورند.
2-با کاغذ PH:باز ضعیف این کاغذ را به رنگ سبز در می آورد ولی باز ضعیف این کاغذ را به رنگ آبی یا بنفش در می آورد.
3-با محلول فنالفتالئین:فنل بی رنگ است اما باز ها آن را به رنگ ارغوانی در می آورند.
کاغذ PH:شناساگری است خنثا به رنگ زرد که 14 عدد دارد از 0 تا 14 . محدوده ی 0 تا 6 اسیدی است . PH7 خنثی است از 8 تا 14 محدوه ی باز هاست.

توجه:ادامه ی انمیمیشن های این فصل در صغحه ی دیگری است برای مشاهده ی دیگر انیمیشن های فصل دوم روی لینک زیر کلیک نمایید
 دانلود کل فایلهای این فصل
دانلود کل فایلهای این فصل
حجم(152KB)
 رمز فایل:www.oloomw.dde.ir
رمز فایل:www.oloomw.dde.ir

پایان فصل دوم